Aufbauov princíp je základná metóda, ktorá nám hovorí, ako sú elektróny naplnené v atómovom orbitále. Podľa Aufbauovho princípu sa plnenie elektrónov v základnom stave atómu riadi základným vzorom. Tento princíp nám hovorí, že elektróny v atómovom orbitále ľubovoľných atómov sú zaplnené vzostupne podľa svojej energie a na zistenie energie atómového orbitálu sa riadia pravidlom n+l.
Princíp štruktúry
V tomto článku sa podrobne dozvieme o princípe Aufbau, vlastnostiach princípu Aufbau, jeho výnimkách a obmedzeniach.
Definícia princípu štruktúry
Aufbauov princíp hovorí, že
spustiť shell skriptu
Elektróny v rôznych orbitáloch sa zapĺňajú v rastúcom poradí ich energie, t. j. orbitál s najnižšou energiou sa zaplní ako prvý a orbitál s najvyššou energiou sa vyplní ako posledný.
Slovo „Aufbau“ v nemčine znamená „Budovanie“. Vznik orbitálov znamená naplnenie orbitálov elektrónmi. Uvádza, že elektróny v atómových orbitáloch sú vyplnené vo vzostupnom poradí energie atómového orbitálu. A energia atómového orbitálu sa vypočíta pomocou pravidla n+l, ktoré hovorí, či elektrón s vyšším číslom hodnoty n+l má vyššiu energiu. V pravidle diskutovanom v predchádzajúcom riadku n hovorí hlavné kvantové číslo a l hovorí azimutálne kvantové číslo.
Ak majú dva elektróny rovnakú hodnotu n+l, potom elektrón s menšou hodnotou n má menšiu energiu a je naplnená ako prvá. Poradie plnenia elektrónov v atómovom orbitále je diskutované nižšie.
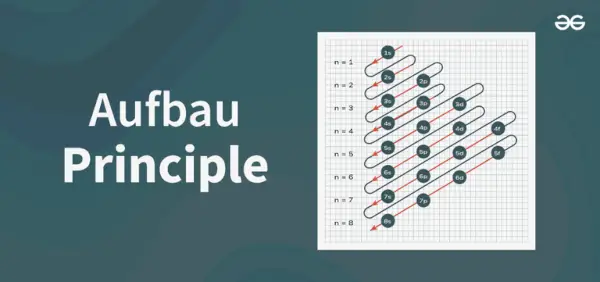
Štruktúra principiálneho diagramu
Diagram Aufbauovho princípu je diagram, ktorý znázorňuje poradie plnenia elektrónov v atóme.
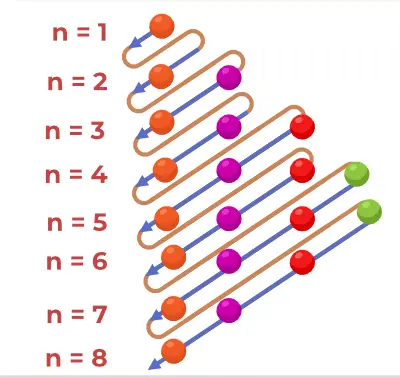
Štruktúra principiálneho diagramu
Štruktúra základného vzorca
Aufbauov vzorec je vzorec, ktorý hovorí o poradí, v ktorom sú elektróny naplnené v atómovom orbitále. Atómový orbitálny vzorec je
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Štruktúra triedy princípov 11
Princíp Aufbau je dôležitým princípom chémie pre študentov v triede 11. Tento princíp hovorí, že
Elektróny v atómovom orbitále atómu sú vyplnené vo vzostupnom poradí energie atómového orbitálu, ktorá sa vypočíta pomocou pravidla (n+l).
Kreslenie schémy štruktúry
Diagram Aufbau je nakreslený pomocou krokov pridaných nižšie,
- Nájdite počet elektrónov, ktoré majú byť naplnené v atómoch.
- Vieme, že v atóme je
- s-orbital pojme maximálne 2 elektróny.
- p-orbital pojme maximálne 6 elektrónov.
- d-orbital pojme maximálne 10 elektrónov.
- f-orbital pojme maximálne 14 elektrónov.
- Doplňte prvé dva elektróny v 1s orbitále.
- Potom postupujte podľa pravidla n+l a následne podľa toho naplňte elektróny.
Hlavné znaky princípu štruktúry
Rôzne vlastnosti princípu Aufbau sú:
- Energia orbitálu závisí od súčtu hodnôt hlavného kvantového čísla (n) a azimutálneho súčtu čísla (I). Toto sa nazýva (n + l) pravidlo . Podľa tohto pravidla,
- V neutrálnom izolovanom atóme platí, že čím nižšia je hodnota (n + l) pre orbitál, tým nižšia je jeho energia. Ak však majú dva rôzne typy orbitálov rovnakú hodnotu (n + l), potom majú orbitály s nižšou hodnotou n menšiu energiu.
| Typ orbitálu | Hodnota n | Hodnota l | Hodnota n+l | Relatívna energia |
|---|---|---|---|---|
| 1 s | 1 | 0 | 1+0 = 1 | Najnižšia energia |
| 2s | 2 | 0 | 2+0 = 2 | Vyššia energia ako 1s orbitálna |
| 2p foreach java 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | Orbitály 2p (n=2) majú nižšiu energiu ako orbitály 3s(n=3). |
| 3p nahradenie reťazca v jazyku Java 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Orbitály 3p (n=3) majú nižšiu energiu ako orbitály 4s(n=4). |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 ridhima tiwari 4+1 = 5 | 3d orbitaly (n=3) majú nižšiu energiu ako 4p(n=4) orbitaly. |
Z opisu uvedeného v tabuľke vyplýva, že energie rôznych orbitálov sa zvyšujú so zvyšujúcim sa počtom hlavného kvantového čísla.
- Teda poradie, v ktorom sú elektróny naplnené v atómovom orbitále atóm je, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektronická konfigurácia pomocou princípu Aufbau
The elektronická konfigurácia použitie Aufbauovho princípu pre niekoľko prvkov je popísané nižšie:
Elektrónová konfigurácia síry
Atómové číslo síry je 16, t.j. má 16 elektrónov
Teraz pomocou princípu Aufbau je elektronická konfigurácia síry napísaná ako,
[S] = 1 s 2 2s 2 2p 6 3s 2 3p 4
Elektrónová konfigurácia dusíka
Atómové číslo dusíka je 7, t.j. má 7 elektrónov
Teraz pomocou Aufbauovho princípu je elektronická konfigurácia dusíka napísaná ako,
[N] = 1 s 2 2s 2 2p 3
Výnimky z konštrukčného princípu
Existuje niekoľko výnimiek z princípu Aufbau, ktorými sú chróm a meď. Ich elektronická konfigurácia je
Elektronická konfigurácia prehliadača Chromium
Elektronická konfigurácia Chromium podľa princípu Aufbau by mala byť
- Cr(24): [Ar]3d 4 4s 2
Vyššie uvedená konfigurácia však nie je správna, pretože skutočná elektronická konfigurácia Chromium(Cr) je,
- Cr(24): [Ar]3d 5 4s 1
Dôvodom tejto elektronickej konfigurácie je, že polovyplnený d-atómový orbitál je stabilnejší než je orbitál naplnený podľa Aufbauovho princípu.
Elektronická konfigurácia medi
Elektronická konfigurácia medi podľa princípu Aufbau by mala byť,
- Cu(29): [Ar]3d 9 4s 2
Vyššie uvedená konfigurácia nie je správna, pretože skutočná elektronická konfigurácia medi (Cu) je,
- Cu(29): [Ar]3d 10 4s 1
Dôvodom tejto elektronickej konfigurácie je, že plne naplnený d-atómový orbitál je stabilnejší než je orbitál naplnený podľa Aufbauovho princípu.
jedinečný kľúč mysql
Čítaj viac
- Kvantové čísla
- Tvar atómových orbitálov
- Atómová štruktúra
Princíp štruktúry – často kladené otázky
Čo je Aufbauov princíp v chémii?
Aufbauov princíp v chémii je základným princípom, ktorý sa používa na vyplnenie elektrónov v atómových orbitáloch akéhokoľvek atómu. Táto veta nám hovorí o poradí, v ktorom sú elektróny naplnené v atómovom orbitále.
Kto dal princíp Aufbau?
Aufbauov princíp bol daný slávnym dánskym fyzikom Nielsom Bohrom v roku 1920.
Čo je Pauliho princíp vylúčenia?
Pauliho princíp vylúčenia uvádza, že v atóme žiadne dva elektróny nemajú všetky štyri kvantové číslo t on rovnaký. Aspoň jedno z kvantových čísel je odlišné pre všetky elektróny v atóme.
Čo je pravidlo n+l?
Pravidlo n+l je pravidlo, ktoré uvádza, že energia orbitálu závisí od súčtu hlavného kvantového čísla (n) a azimutálneho kvantového čísla (l). toto pravidlo sa nazýva pravidlo (n+l).
Aké sú výnimky z princípu Aufbau?
Výnimkou z princípu Aufbau sú
- Elektronická konfigurácia Chromium Cr[24]
- Elektronická konfigurácia medi Cu[29]
