Atómové orbitály , čo sú matematické funkcie, popisujú vlnové správanie elektrónov (alebo elektrónových párov) v atóme. Atómové orbitály majú rôzne tvary podľa typu. Rôzne tvary atómových orbitálov opisujú, že existuje buď najvyššia alebo nulová pravdepodobnosť nájdenia elektrónu okolo jadra v niektorých smeroch. Existujú štyri typy orbitálov, z ktorých každý má iný tvar a je reprezentovaný písmenami s, p, d a f. Orbitály s a p sa berú do úvahy, pretože sú najrozšírenejšie v chemickej a biologickej chémii. An s-orbitálny má v strede sférické jadro, a p-orbital má tvar činky a štyri z piatich d orbitály sú v tvare ďateliny. Piaty orbitál d je tvarovaný ako dlhá činka so šiškou v strede. Orbitály atómu sú organizované do vrstiev alebo elektrónových obalov.
Čo sú atómové orbitály?
Atómové orbitály sú trojrozmerný priestor v blízkosti jadra atómu, kde je maximálna možnosť objavenia elektrónu.
Atóm môže mať podľa kvantového atómového modelu nekonečný počet orbitálov. Tieto orbitály možno klasifikovať na základe ich veľkosti, tvaru alebo orientácie. Užší orbitál znamená, že je väčšia pravdepodobnosť zachytenia elektrónu blízko jadra. Funkcia orbitálnej vlny je často známa ako matematická funkcia, ktorá sa používa na vyjadrenie súradníc elektrónu. Pravdepodobnosť lokalizácie elektrónu je reprezentovaná druhou mocninou orbitálnej vlnovej funkcie. Táto vlnová funkcia tiež pomáha pri vytváraní diagramov hraničných plôch.
Funkcia orbitálnej vlny
The kvantový atómový model predpovedá, že atóm môže mať obrovské množstvo orbitálov. Tieto orbitály môžu byť zoskupené podľa ich veľkosti, geometrie alebo sklonu. Zmenšená veľkosť orbity zvyšuje pravdepodobnosť získania elektrónu blízko jadra. Matematická funkcia používaná na reprezentáciu súradníc elektrónu sa nazýva funkcia orbitálnej vlny . Pravdepodobnosť objavenia elektrónu je reprezentovaná druhou mocninou orbitálnej vlnovej funkcie.
Túto vlnovú funkciu môžeme použiť aj na vytvorenie diagramov hraničných plôch. Tvar orbitálov môžeme lepšie pochopiť pomocou diagramov hraničných plôch konštantnej hustoty pravdepodobnosti pre rôzne orbitály.
numpy dot produkt
Tvary atómových orbitálov
Tvary atómových orbitálov sa líšia. To znamená, že rozdelenia pravdepodobnosti elektrónov, ktoré opisujú okolo jadra, sú rôzne. Skutočnosť, že elektróny v rôznych orbitáloch sú pravdepodobne umiestnené v rôznych oblastiach okolo materského jadra, a preto zažívajú jeho príťažlivosť s rôznymi silami, je jedným z dôvodov, prečo sa orbitály pohybujú v energii. Je úžasné, že všetky orbitály v danom obale atómu vodíka majú rovnakú energiu, pričom majú rôzne formy. Je to spôsobené elimináciou rôznych príspevkov súvisiacich s energiou.
Ale akonáhle je tam druhý elektrón, degenerácia zmizne.
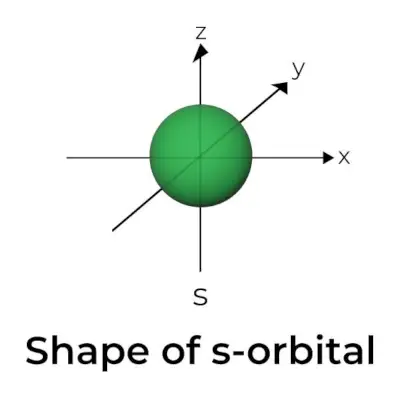
Tvar s-orbitálu
- Diagram povrchu orbitálnej hranice pripomína guľu s jadrom v strede, ktorá môže byť znázornená v dvoch rozmeroch ako kruh.
- s-orbitály sú sféricky symetrické, čo znamená, že pravdepodobnosť nájdenia elektrónu v danej vzdialenosti je vo všetkých smeroch rovnaká.
- Rovnako sa ukazuje, že veľkosť orbitálu s sa zvyšuje so zvyšujúcou sa hodnotou primárneho kvantového čísla (n); teda 4s> 3s> 2s> 1s.
- Uzlový bod je miesto, kde nie je šanca nájsť elektrón. Uzly sú rozdelené do dvoch typov: radiálne uzly a uhlové uzly. Vzdialenosť od jadra je vypočítaná pomocou radiálnych uzlov, zatiaľ čo orientácia je určená uhlovými uzlami.
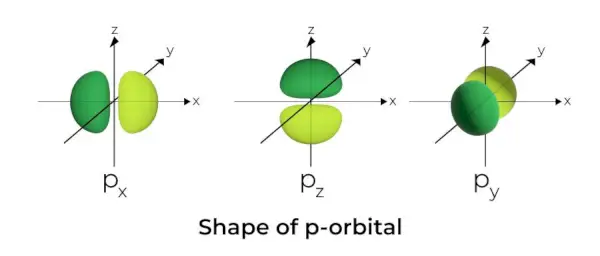
Tvar p-orbitálu
- Orbitály p sú tvorené ako činky.
- Orbitálny uzol p sa nachádza v strede jadra.
- Kvôli prítomnosti troch orbitálov môže orbitál p zaberať maximálne šesť elektrónov.
- Každý p orbitál sa skladá z dvoch častí známych ako laloky, ktoré sú umiestnené na oboch stranách roviny, ktorá prechádza cez jadro.
- Každý p orbitál má časti známe ako laloky na oboch stranách roviny, ktorá prechádza cez jadro. V rovine, kde sa tieto dva laloky pretínajú, je pravdepodobnosť nájdenia elektrónu nulová.
- Tieto tri orbitály sú známe ako degenerované orbitály, pretože majú rovnakú veľkosť, tvar a energiu.
- Jediný rozdiel medzi orbitálmi je orientácia lalokov. Pretože sú laloky orientované pozdĺž osi x, y alebo z, sú pomenované 2px, 2pya 2pz. Na výpočet počtu uzlov sa používa vzorec n –2.
- Podobne ako v prípade orbitálov s, veľkosť a energia orbitálov p rastie so zvyšujúcim sa primárnym kvantovým číslom (4p> 3p> 2p).
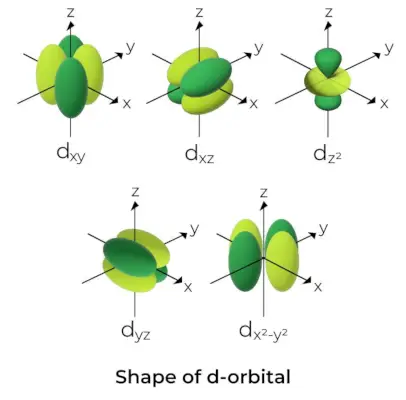
Tvar d-Orbitalu
- Pre d orbitály je magnetické orbitálne kvantové číslo dané ako (-2,-1,0, 1,2). V dôsledku toho môžeme tvrdiť, že existuje päť d-orbitálov.
- Tieto orbitály sú označené symbolmi dxy, dyz, dxz, dX2-a2a ds2.
- Formy prvých štyroch orbitálov d sú si navzájom podobné, čím sa líšia od ds2orbitál, ale energia všetkých piatich d orbitálov je rovnaká.
Tvar f-Orbitalu
- Forma orbitalu f je rozptýlená. Pretože hodnota l=3 pre orbitál f, minimálna hodnota primárneho kvantového čísla n je 4.
- Ekvivalentné hodnoty v ml pre orbitál f sú (-3,–2, –1, 0, +1, +2, +3).
- Výsledkom je, že pre l = 3 existuje sedem orbitálov f.

vlk alebo líška
Degenerované orbitály
Degenerované orbitály sú tie, ktoré majú rovnakú energiu. Tieto orbitály sú odlišné (môžu byť orientované odlišne v priestore okolo atómové jadro ), no majú rovnakú energiu. V prítomnosti vonkajšieho poľa nie je degenerácia p orbitálu ovplyvnená; degeneráciu orbitálov f a d však možno prelomiť aplikáciou vonkajšieho poľa na systém (buď elektrického alebo magnetického poľa).
Len málo orbitálov bude mať vyššiu energiu, zatiaľ čo iné budú mať nižšiu energiu. Degenerácia už v systéme nebude existovať. Napríklad orbitály d sa skladajú z piatich degenerovaných orbitálov, ktoré majú všetky rovnakú energiu.
Čítaj viac:
- Molekulárna orbitálna teória
- Naplnenie orbitálu v atóme
- Hybridizácia
Časté otázky o tvaroch atómových orbitálov
Otázka 1: Ako fungujú orbitály?
odpoveď:
Atómový orbitál je matematický výraz, ktorý vyjadruje vlnové správanie jedného elektrónu alebo páru elektrónov v atóme v atómovej teórii a kvantovej mechanike. Každý orbitál zaberie maximálne dva elektróny, každý s vlastným množstvom spinu.
spúšťanie skriptov v linuxe
Otázka 2: Čo je uzlová rovina?
odpoveď:
Rovina, kde je pravdepodobnosť nájdenia elektrónu zanedbateľná alebo nulová, sa nazýva uzlová rovina.
Otázka 3: Koľko orbitálov existuje?
triedenie výberu v jave
odpoveď:
Pretože podúroveň s má len jeden orbitál, môžu byť prítomné iba dva elektróny. Pretože podúroveň p obsahuje tri orbitály, môže byť prítomných maximálne šesť elektrónov. Pretože podúroveň d obsahuje 5 orbitálov, môže byť prítomných maximálne 10 elektrónov. A každá zo štyroch podúrovní má sedem orbitálov, ktoré môžu obsahovať maximálne 14 elektrónov.
Otázka 4: Ktoré orbitály majú najväčšiu energiu?
odpoveď:
algoritmus triedenia vloženia
Najviac energie má orbitálna 1s. Energia elektrónu je množstvo energie potrebné na to, aby sa dostal von z elektrickej bubliny atómu.
Otázka 5: Aký je rozdiel medzi plášťom a orbitálom?
odpoveď:
V atóme je obal súborom podplášťov rovnakej teórie kvantových čísel, n. Každý z orbitálov má dva elektróny a elektróny v rovnakom orbitále majú rovnakú definíciu veľkosti, veľkosti momentu hybnosti a magnetického kvantového čísla.
Otázka 6: Čo je to väzba sigma a pi?
odpoveď:
Atómové orbitálne prekrytie vytvára sigma a pi väzby. Sigma väzby sa vytvárajú prekrývaním atómových orbitálnych lalokov, zatiaľ čo Pi väzby sa vytvárajú, keď sa jeden atómový orbitálny lalok prekrýva s druhým.
