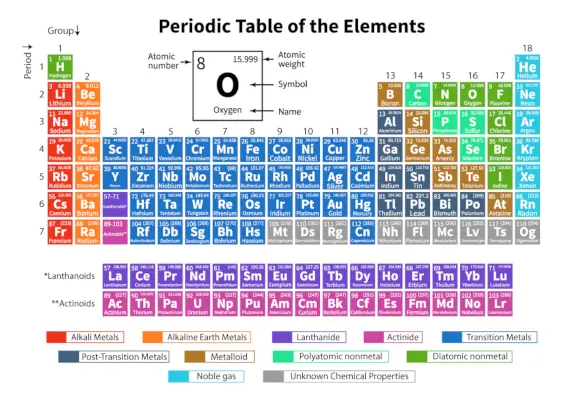
The Periodická tabuľka prvkov je systematické usporiadanie 118 známych chemických prvkov. Tieto chemické prvky sú usporiadané podľa rastúceho atómového čísla. Vodorovné riadky zľava doprava sa nazývajú bodky, zatiaľ čo zvislé stĺpce zhora nadol sa nazývajú skupiny v periodickej tabuľke.
Obsah
- Čo je to periodická tabuľka?
- Zoznam prvkov periodickej tabuľky
- Dôležité pojmy v periodickej tabuľke
- Klasifikácia prvkov v periodickej tabuľke
- Mendelejevova periodická tabuľka
- Časté otázky o periodickej tabuľke prvkov
Čo je to periodická tabuľka?
Periodická tabuľka je tabuľkové znázornenie, v ktorom sú všetky známe chemické prvky usporiadané do horizontálnych riadkov nazývaných periódy a vertikálnych stĺpcov nazývaných skupiny na základe ich atómové číslo a atómovú štruktúru.
Je to usporiadanie všetkých známych prvkov, a preto poskytuje informácie o prvkoch, ako je ich hmotnosť, elektrónové číslo, elektrónová konfigurácia a ich jedinečné chemické vlastnosti.
Zoznam prvkov periodickej tabuľky
Tu je tabuľka predstavujúca 118 prvkov periodickej tabuľky. Uvedené prvky sú usporiadané podľa rastúceho poradia atómového čísla a ich príslušnej atómovej hmotnosti, symbolu, hustoty a elektronegativity.
| Prvky v periodickej tabuľke s atómovou hmotnosťou | |||||
|---|---|---|---|---|---|
| Atómové číslo | Názov chemického prvku | Symbol | Atómová hmotnosť (amu) | Hustota (g/cm 3 ) | Elektronegativita |
| 1 | Vodík | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | hélium | On | 4,0026 | 0,0001785 | – |
| 3 | Lítium | To | 6,941 | 0,534 | 0,98 |
| 4 | Berýlium | Buď | 9.0122 | 1,85 | 1,57 |
| 5 | bór | B | 10 811 | 2.34 | 2.04 |
| 6 | Uhlík | C | 12.0107 | 2,267 | 2.55 |
| 7 | Dusík | N | 14,0067 | 0,0012506 | 3.04 |
| 8 | Kyslík | O | 15,9994 | 0,001429 | 3.44 |
| 9 | Fluór | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | Áno | 20,1797 | 0,0009002 | – |
| jedenásť | Sodík | Už | 22,9897 | 0,968 | 0,93 |
| 12 | magnézium | Mg | 24,305 | 1,738 | 1.31 |
| 13 | hliník | K | 26,9815 | 2.7 | 1.61 |
| 14 | Silikón | Áno | 28,0855 | 2,329 | 1.9 |
| pätnásť | Fosfor | P | 30,9738 | 1 823 | 2.19 |
| 16 | Síra | S | 32 065 | 2.07 | 2.58 |
| 17 | Chlór | Cl | 35,453 | 0,0032 | 3.16 |
| 18 | argón | S | 39,948 | 0,001784 | – |
| 19 | Draslík | K | 39,0983 | 0,89 | 0,82 |
| dvadsať | Vápnik | To | 40 078 | 1,55 | 1 |
| dvadsaťjeden | Scandium | Sc | 44,9559 | 2,985 | 1.36 |
| 22 | titán | z | 47,867 | 4,506 | 1.54 |
| 23 | Vanád | V | 50,9415 | 6.11 | 1,63 |
| 24 | Chromium | Cr | 51,9961 | 7.15 | 1.66 |
| 25 | mangán | Mn | 54,938 | 7.21 | 1,55 |
| 26 | Železo | Viera | 55,845 | 7,874 | 1,83 |
| 27 | kobalt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nikel | In | 58,6934 | 8,908 | 1,91 |
| 29 | Meď | S | 63,546 | 1.9 | 60 |
| 30 | Zinok | Zn | 65,39 | 1,65 | 70 |
| 31 | Gálium | Tu | 69,723 | 1,81 | 19 |
| 32 | Germánium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arzén | Ako | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selén | ON | 78,96 | 2.55 | 0,05 |
| 35 | bróm | Br | 79,904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83,798 | 3 | 1×10-4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | stroncium | Sr | 87,62 | 0,95 | 370 |
| 39 | Ytrium | A | 88,906 | 1.22 | 33 |
| 40 | Zirkónium | Zr | 91,224 | 1.33 | 165 |
| 41 | niób | Pozn | 92 906 | 1.6 | dvadsať |
| 42 | molybdén | Mo | 95,94 | 2.16 | 1.2 |
| 43 | technécium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | ruténium | Ru | 101,07 | 2.2 | 0,001 |
| Štyri | Rhodium | Rh | 102,91 | 2.28 | 0,001 |
| 46 | paládium | Pd | 106,42 | 2.2 | 0,015 |
| 47 | Strieborná | o | 107,87 | 1,93 | 0,075 |
| 48 | kadmium | Cd | 112 411 | 1,69 | 0,159 |
| 49 | Indium | In | 114,82 | 1,78 | 0,25 |
| päťdesiat | Verte | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimón | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Telúr | The | 127,6 | 2.1 | 0,001 |
| 53 | jód | ja | 126,9045 | 2.66 | 0,45 |
| 54 | xenón | Auto | 131,293 | 2.6 | 3×10−5 |
| 55 | Cézium | Čs | 132,91 | 0,79 | 3 |
| 56 | bárium | nie | 137,327 | 0,89 | 425 |
| 57 | Lantán | The | 138,91 | 1.1 | 39 |
| 58 | Cerium | Toto | 140,12 | 1.12 | 66,5 |
| 59 | Prazeodym | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodym | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Promethium | Popoludnie | 145 | 1.13 | 2×10–19 |
| 62 | Samarium | Sm | 150,36 | 1.17 | 7.05 |
| 63 | európium | EÚ | 151 964 | 1.2 | 2 |
| 64 | Gadolínium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | Tie | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Komu | 164,9303 | 1.23 | 1.3 |
| 68 | Erbium | Je | 167,259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1.25 | 0,52 |
| 70 | Ytterbium | Yb | 173,04 | 1.1 | 3.2 |
| 71 | Paríž | Lu | 174,967 | 1.27 | 0,8 |
| 72 | hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Obklad | 180,9479 | 1.5 | 2 |
| 74 | Volfrám | IN | 183,84 | 2.36 | 1.3 |
| 75 | rénium | Re | 186,207 | 1.9 | 7×10-4 |
| 76 | Osmium | vy | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | A | 192,22 | 2.2 | 0,001 |
| 78 | Platinum | Pt | 195,08 | 2.28 | 0,005 |
| 79 | Zlato | o | 196,97 | 2.54 | 0,004 |
| 80 | Merkúr | Hg | 200,59 | 2 | 0,085 |
| 81 | Tálium | Tl | 204,3833 | 1.62 | 0,85 |
| 82 | Viesť | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bizmut | S | 208,9804 | 2.02 | 0,009 |
| 84 | polónium | Po | 209 | 2 | 2×10–10 |
| 85 | astatín | o | 210 | 2.2 | 3×10–20 |
| 86 | Radón | Rn | 222 | 2.2 | 4×10–13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10–18 |
| 88 | Rádium | slnko | 226 | 0,9 | 9×10-7 |
| 89 | aktinium | A | 227 | 1.1 | 5,5×10–10 |
| 90 | Tórium | Th | 232,0381 | 1.3 | 9.6 |
| 91 | Protaktínium | Dobre | 231,0359 | 1.5 | 1,4 × 10-6 |
| 92 | Urán | IN | 238,0289 | 1.38 | 2.7 |
| 93 | Neptún | napr | 237 | 1.36 | ≤ 3 × 10-12 |
| 94 | Plutónium | Mohol | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americium | Am | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1.28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | Kalifornia | Porov | 251 | 1.3 | – |
| 99 | Einsteinium | Je | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendelejev | Md | 258 | 1.3 | – |
| 102 | Noble | Nie | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Roentgenium | Rg | 282 | – | – |
| 112 | Koperníka | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | In | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | A | 294 | – | – |
Dôležité pojmy v periodickej tabuľke
| Podmienky zahŕňajú programovanie c | Popis |
|---|---|
| Atómové číslo | Počet protónov, ktoré tvoria jadro prvku, sa nazýva jeho atómové číslo (Z). napr. Uhlík potom obsahuje 6 protónov, takže jeho atómové číslo musí byť iba 6. |
| Atómová hmotnosť | Je definovaná ako priemerná hmotnosť atómov prvku. Meria sa na základe relatívneho prirodzeného zastúpenia izotopov prvku. Atómová hmotnosť sa tiež nazýva atómová hmotnosť (A). Meria sa v jednotke atómovej hmotnosti (amu). |
| Obdobie | Vodorovné riadky zľava doprava v periodickej tabuľke sa nazývajú periódy. V periodickej tabuľke je celkovo 7 období. Prvky sú usporiadané horizontálne kvôli ich podobnostiam vo vlastnostiach, ako sú rovnaké atómové orbitály atď. |
| Skupina | Vertikálne stĺpce zhora nadol v periodickej tabuľke sa nazývajú skupiny. V periodickej tabuľke je celkovo 18 skupín. Prvky sú usporiadané vertikálne kvôli podobnosti vlastností, pretože majú rovnaký počet valenčných elektrónov. |
| Symbol prvku | Symbol je pojem, ktorý sa používa na vyjadrenie chemického prvku pomocou písmena alebo kombinácie dvoch až troch písmen. napr. Chemický symbol uhlíka je C, zatiaľ čo Fe sa používa pre železo atď. |
Klasifikácia prvkov v periodickej tabuľke
118 prvkov je usporiadaných do 7 období a 18 skupín, ako je uvedené vyššie. Ďalej sú prvky rozdelené do rôznych blokov.
| Blokovať | Zahrnuté prvky | Posledná elektrónová subškrupina naplnená |
|---|---|---|
| s-blok | Skupina 1 (alkalické kovy) | s-subshell |
| Skupina 2 (kovy alkalických zemín) | ||
| p-blok | Skupina 13 (Bórová rodina) | p-subshell |
| Skupina 14 (Carbon Family) | ||
| Skupina 15 (rodina dusíka) | ||
| Skupina 16 (kyslíková rodina) | ||
| Skupina 17 (fluórová rodina) | ||
| d-blok | Skupiny 3 až 12 (prechodové prvky) | d-subshell |
| f-blok | Lantanoidy (prvky vzácnych zemín) | f-subshell |
| aktinidy |
Mendelejevova periodická tabuľka
S cieľom reprezentovať podobnosti a trendy v správaní prvkov Mendelejev vyvinul periodickú tabuľku, čo je usporiadanie prvkov v rastúcom poradí atómovej hmotnosti v tabuľkovej forme.

Podľa Mendelejevovej periodickej tabuľky boli prvky usporiadané podľa ich základných vlastností, atómovej hmotnosti a chemických vlastností. V čase Mendelejevovej práce bolo známych iba 63 prvkov. V Mendelejevovej periodickej tabuľke boli vodorovné riadky a zvislé stĺpce označené ako skupiny a obdobia.
Mendelejevova periodická tabuľka však zlyháva kvôli mnohým nedostatkom. Niektoré z nich sú, že sa v ňom nepodarilo označiť vodík a vzácne plyny. Tiež rastúce poradie atómovej hmotnosti prvkov nebolo v tabuľke pravidelné. Dokonca, objav izotopov porušuje Mendelejevov periodický zákon.
Čítaj viac:
- Moderná periodická tabuľka
- Mendelejevova periodická tabuľka
- Moderný periodický zákon
- História periodickej tabuľky
- Atómová štruktúra
Časté otázky o periodickej tabuľke prvkov
Čo je to periodická tabuľka prvkov?
Periodická tabuľka prvkov je tabuľkové usporiadanie chemických prvkov usporiadaných podľa ich atómového čísla, elektrónovej konfigurácie a opakujúcich sa chemických vlastností. Tabuľka je rozdelená na riadky nazývané obdobia a stĺpce nazývané skupiny alebo rodiny.
Kto objavil periodickú tabuľku prvkov?
Periodickú tabuľku prvkov neobjavil jediný človek, no o jej vývoj sa zaslúžil ruský chemik Dmitri Mendelejev, ktorý v roku 1869 usporiadal prvky na základe ich vlastností.
Kto vytvoril modernú periodickú tabuľku?
V roku 1913 Henry Moseley predstavil aktualizovanú verziu periodickej tabuľky, bežne označovanú ako Moderná periodická tabuľka.
Ako je usporiadaná periodická tabuľka?
Periodická tabuľka je usporiadaná podľa rastúceho atómového čísla, pričom prvky sú zoskupené na základe podobných chemických vlastností a usporiadané do období (riadkov) a skupín (stĺpcov).
Čo je atómové číslo?
Počet protónov, ktoré tvoria jadro prvku, sa nazýva jeho atómové číslo (Z). napr. Uhlík teda obsahuje 6 protónov, jeho atómové číslo musí byť iba 6.
Môžu mať dva rôzne prvky rovnaké atómové číslo?
Počet neutrónov v atóme z dvoch rôznych prvkov môže byť podobný, ale počet protónov nebude nikdy rovnaký. Každý prvok má špecifický počet protónov, ktorý zodpovedá počtu atómov.
Ako vypočítať atómovú hmotnosť?
Atómovú hmotnosť možno vypočítať sčítaním hmotnosti protónov a neutrónov v prvku.
Čo je to skupina v periodickej tabuľke?
Stĺpec v periodickej tabuľke sa vzťahuje na skupinu periodickej tabuľky. Prvky rovnakej skupiny majú podobné fyzikálne a chemické vlastnosti.
