Koncept hybridizácia je definovaný ako proces spojenia dvoch atómových orbitálov za vzniku nového typu hybridizovaných orbitálov. Toto premiešanie zvyčajne vedie k vytvoreniu hybridných orbitálov s úplne odlišnými energiami, tvarmi atď. Hybridizáciu primárne vykonávajú atómové orbitály rovnakej energetickej úrovne. Tohto procesu sa však môžu zúčastniť plne naplnené aj napoly vyplnené orbitály, ak sú ich energie rovnaké. Koncept hybridizácie je rozšírením teórie valenčných väzieb, ktorá nám pomáha pochopiť tvorbu väzieb, energie väzieb a dĺžky väzieb.
Čo je hybridizácia?
Keď sa dva atómové orbitály spoja a vytvoria hybridný orbitál v molekule, energia orbitálov jednotlivých atómov sa prerozdelí tak, aby vznikli orbitály s ekvivalentnou energiou. Toto je známe ako hybridizácia.
Atómové orbitály porovnateľných energií sa zmiešajú počas hybridizačného procesu, ktorý väčšinou zahŕňa zlúčenie dvoch orbitálov alebo dvoch orbitálov „p“ alebo zmiešanie orbitálu „s“ s orbitálom „p“, ako aj „s“ orbital s 'd' orbitalom.
Hybridné orbitály sú nové orbitály vytvorené ako výsledok tohto procesu. Ešte dôležitejšie je, že hybridné orbitály možno použiť na vysvetlenie vlastností atómovej väzby a molekulárnej geometrie. Napríklad uhlík tvorí štyri jednoduché väzby, v ktorých sa orbitál valenčnej vrstvy s kombinuje s tromi orbitálmi valenčnej vrstvy p. Táto kombinácia generuje štyri ekvivalentné sp3zmesi. Tie budú usporiadané do štvorstenu okolo uhlíka, ktorý je naviazaný na štyri rôzne atómy.
Kroky na určenie typu hybridizácie
Aby sme pochopili typ hybridizácie v atóme alebo ióne, musia sa dodržiavať nasledujúce pravidlá.
- Najprv určte celkový počet valenčných elektrónov obsiahnutých v atóme alebo ióne.
- Potom spočítajte počet osamelých párov pripojených k tomuto atómu alebo iónu.
- Teraz je možné vypočítať požadovaný počet orbitálov pridaním počtu duplexov alebo oktetov a počtu osamelých párov elektrónov.
- Treba poznamenať, že geometria orbitálov v atómoch alebo iónoch je iná, keď neexistuje žiadny osamelý pár elektrónov.
Vlastnosti hybridizácie
- Hybridizácia prebieha medzi atómovými orbitálmi s rovnakými energiami.
- Počet vytvorených hybridných orbitálov sa rovná počtu atómových orbitálov, ktoré sa zmiešajú.
- Nie je potrebné, aby sa hybridizácie zúčastnili všetky napoly vyplnené orbitály. Zúčastniť sa môžu dokonca aj orbitály, ktoré sú úplne naplnené, ale majú mierne premenlivú energiu.
- K hybridizácii dochádza iba počas tvorby väzby, nie v jedinom atóme plynu.
- Ak je známa hybridizácia molekuly, možno predpovedať tvar molekuly.
- Väčší lalok hybridného orbitálu je vždy pozitívny, zatiaľ čo menší lalok na opačnej strane je vždy negatívny.
Typy hybridizácie
Hybridizáciu možno klasifikovať ako sp3, sp2, sp, sp3d, sp3d2, alebo sp3d3na základe typov orbitálov zapojených do miešania.
očíslovať abecedu
sp Hybridizácia
Vyskytuje sa, keď sa jeden orbitál s a jeden p v hlavnom obale atómu spoja a vytvoria dva nové ekvivalentné orbitály. Novovytvorené orbitaly sú známe ako sp hybridizované orbitaly. Vytvára lineárne molekuly pod uhlom 180°. Znamená to kombináciu jedného orbitálu a jedného orbitálu „p“ rovnakej energie, aby sa vytvoril nový hybridný orbitál známy ako hybridizovaný orbitál sp.
- Je tiež známa ako diagonálna hybridizácia.
- Každý sp hybridizovaný orbitál obsahuje rovnaké množstvo znakov s a p.
- Všetky zlúčeniny berýlia, ako napríklad BeF2, No2a BeCl2, sú príklady.

sp2Hybridizácia
Vyskytuje sa, keď sa jeden orbitál s a dva p orbitály toho istého atómového obalu spoja a vytvoria tri ekvivalentné orbitály. Novovzniknuté orbitály sú známe ako sp2hybridné orbitály. Je tiež známa ako trigonálna hybridizácia. Znamená to spojenie jedného orbitálu s dvoma orbitálmi „p“ rovnakej energie, aby sa vytvoril nový hybridný orbitál známy ako sp.2. Zmes trigonálnej symetrie orbitálov s a p sa udržiava na 120 stupňoch. Všetky tri hybridné orbitály zostávajú v rovnakej rovine a zvierajú medzi sebou 120° uhol.
- Každý vytvorený hybridný orbitál má 33,33 % a 66,66 % „p“ charakter.
- Molekuly s trojuholníkovým rovinným tvarom majú centrálny atóm, ktorý je spojený s tromi ďalšími atómami a je sp2hybridizované. Príkladmi sú zlúčeniny bóru.
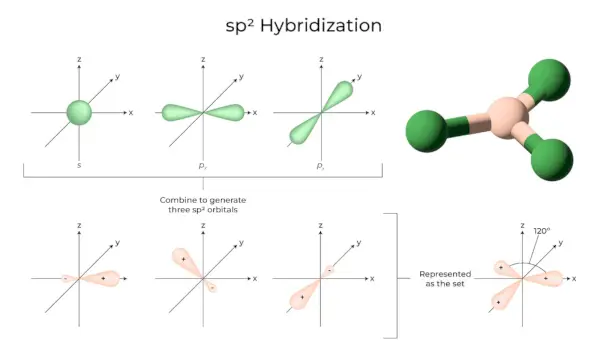
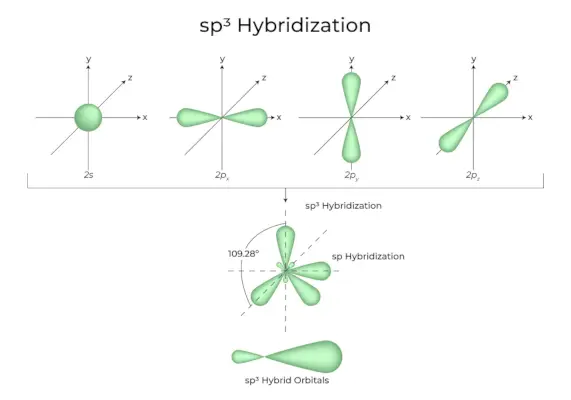
sp3Hybridizácia
Keď sa jeden orbitál „s“ a tri orbitály „p“ z rovnakého obalu atómu spoja a vytvoria štyri nové ekvivalentné orbitály, hybridizácia je známa ako tetraedrická hybridizácia alebo sp.3. Novovzniknuté orbitály sú známe ako sp3hybridné orbitály. Sú nasmerované na štyri rohy pravidelného štvorstenu a zvierajú medzi sebou uhol 109°28′.
- Sp3hybridné orbitály zvierajú 109,28-stupňový uhol.
- Každý hybridný orbitál má 25 % s charakter a 75 % p charakter.
- Etán a metán sú dva príklady.
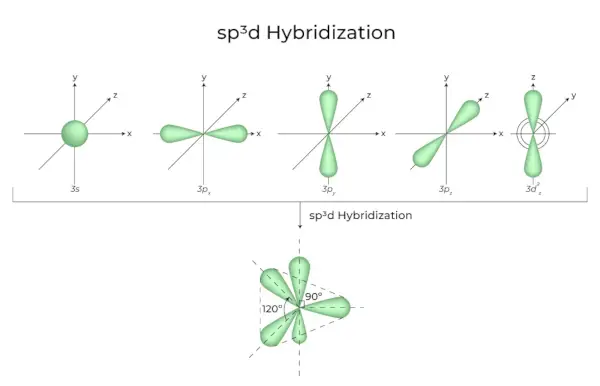
sp3d Hybridizácia
Zmiešanie 1s orbitálov, 3p orbitálov a 1d orbitálov vedie k 5 sp3d hybridizovaným orbitálom rovnakej energie. Ich geometria je trigonálna bipyramídová. Výsledkom kombinácie orbitálov s, p a d je trigonálna bipyramídová symetria. Rovníkové orbitály sú tri hybridné orbitály, ktoré sú navzájom orientované pod uhlom 120° a ležia v horizontálnej rovine.
- Zostávajúce dva orbitály, známe ako axiálne orbitály, sú vo vertikálnej rovine v rovine 90 stupňov rovníkových orbitálov.
- Hybridizácia napríklad v chloride fosforečnom (PCl5).
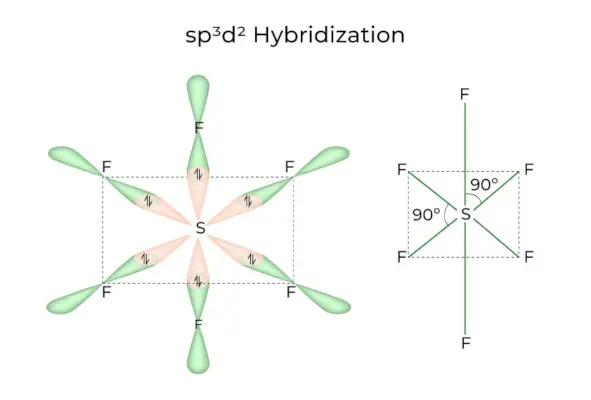
sp3d2 Hybridizácia
Keď sa orbitály 1s, 3p a 2d spoja a vytvoria 6 identických sp3d2hybridné orbitály, hybridizácia sa nazýva sp3d2Hybridizácia. Týchto sedem orbitálov ukazuje na rohy osemstenu. Sú navzájom naklonené v 90-stupňovom uhle.
urobiť while slučku v jave
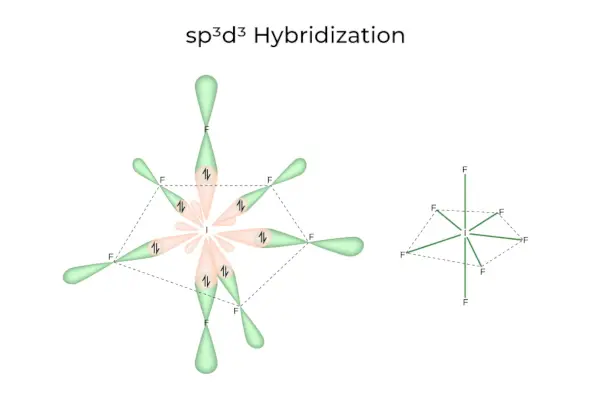
sp3d3Hybridizácia
Má 1s, 3p a 3d orbitály, ktoré sa spoja do 7 identických sp3d3hybridné orbitály. Týchto sedem orbitálov ukazuje na rohy päťuholníkovej bipyramídy. napr. AK6.
Tvary hybridizácie
- Lineárne: Sp hybridizácia je spôsobená interakciou dvojelektrónových skupín; orbitálny uhol je 180°. Trigonálna rovina: Sú zapojené tri elektrónové skupiny, čo vedie k sp2hybridizácia; orbitály sú od seba vzdialené 120°. Tetraedrický: Sú zapojené štyri elektrónové skupiny, čo vedie k sp3hybridizácia; orbitálny uhol je 109,5°. Trigonálny bipyramídový: Zapojených je päť elektrónových skupín, čo vedie k sp3d hybridizácia; orbitálne uhly sú 90° a 120°. Oktaedrický: Zapojených je šesť elektrónových skupín, čo vedie k sp3d2hybridizácia; orbitály sú od seba vzdialené 90°.
Časté otázky o Hybridizácia
Otázka 1: Ktorý hybridný orbitál spomedzi sp, sp2 a sp3 je elektronegatívny?
odpoveď:
Percento charakteru s v sp, sp2, a sp3hybridizovaného uhlíka je 50 %, 33,33 % a 25 %. Kvôli sférickému tvaru orbitálu s je jadro priťahované rovnomerne zo všetkých smerov. Výsledkom je, že hybridný orbitál so znakom S bude bližšie k jadru, a teda bude elektronegatívny. Výsledkom je, že sp hybridizovaný uhlík je najviac elektronegatívny.
java len poľa
Otázka 2: Čo sú hybridné orbitály?
odpoveď:
Hybridné orbitály vznikajú spojením štandardných atómových orbitálov a výsledkom je vytvorenie nových atómových orbitálov.
Otázka 3: Akých je päť tvarov hybridizácie?
odpoveď:
Lineárny, trigonálny rovinný, tetraedrický, trigonálny bipyramídový a oktaedrický je päť základných tvarov hybridizácie.
Otázka 4: Prečo molekula amidu vyzerá ako sp3hybridizovaný, ale je sp2?
odpoveď:
np.random.rand
Ak je atóm buď uzavretý dvoma alebo viacerými orbitálmi p, alebo má osamelý pár schopný skočiť do orbitálu p, všeobecný proces hybridizácie sa zmení. Výsledkom je, že v prípade amidovej molekuly sa osamelý pár dostane do orbitálu p, čo vedie k trom susedným paralelným orbitálom p.
Otázka 5: Čo je Bentovo pravidlo?
odpoveď:
Centrálny atóm spojený s mnohými skupinami v molekule bude hybridizovať, čo spôsobí, že orbitály s charakterom viac s budú smerovať k elektropozitívnym skupinám a orbitály s charakterom p budú smerovať k elektronegatívnym skupinám.
