Báza je chemická zlúčenina, ktorá pozostáva z OH–ióny a prijíma protóny. Báza v chémii sú tie zlúčeniny, ktoré sa sfarbujú do červeného lakmusového modrého a keď reagujú s kyselinou, neutralizujú reakciu za vzniku soli a vody. Hodnota pH bázy je vyššia ako 7. Bázy sú horkej chuti a klzké na dotyk. Zásady, ktoré sú rozpustné vo vode, sa nazývajú zásady. Príkladmi báz sú oxidy kovov, hydroxidy kovov atď. Mydlo je príkladom bázy, ktorú používame v každodennom živote. V tomto článku sa podrobne dozvieme o definícii, vlastnostiach a chemických reakciách zásad.

Základná definícia
Báza je definovaná ako chemická zlúčenina, ktorej hodnota pH je vyššia ako 7, prijíma protón, neutralizuje kyselinu a mení červený lakmus na modrý. Vo všeobecnosti oslobodzujú OH–ión pri disociácii. Príklady zahŕňajú NaOH, NaHCO3,atď. Nasleduje niekoľko všeobecných funkcií zobrazených základňou:
- Majú horkú chuť
- Na dotyk sú klzké
- Menia sa červený lakmusovo modrý
- Oslobodzujú OH–ión po rozpustení vo vode
- Vedú elektrický prúd vo forme roztoku
Zásady sú jednou z najdôležitejších chemických zlúčenín, ktoré sa používajú v každodennom živote. Bázy sa používajú ako antacidá na kontrolu kyslosti a v zubných pastách na neutralizáciu bakteriálneho pôsobenia, ktoré produkuje kyselinu v našich ústach a zabraňuje degradácii skloviny a dutiny. Používajú sa tiež ako prášok do pečiva, sóda bikarbóna a prací prášok.
Lewis Base
Lewisove bázy sú zlúčeniny, ktoré majú elektrónový pár a môžu ho darovať zlúčeninám, ktoré majú nedostatok elektrónových párov. Lewisove bázy sú svojou povahou nukleofilné, to znamená, že milujú jadrá, čo znamená, že svojimi elektrónovými pármi útočia na kladne nabité centrum. Príklady Lewisovej bázy zahŕňajú amoniak, pretože v amoniaku (NH3) stredný atóm dusíka má 5 elektrónov, z ktorých 3 sa používajú na vytváranie väzieb s 3 atómami vodíka a jeden elektrónový pár zostáva s atómom N, čím vytvára NH3Lewisova základňa.
Základňa Arrhenius
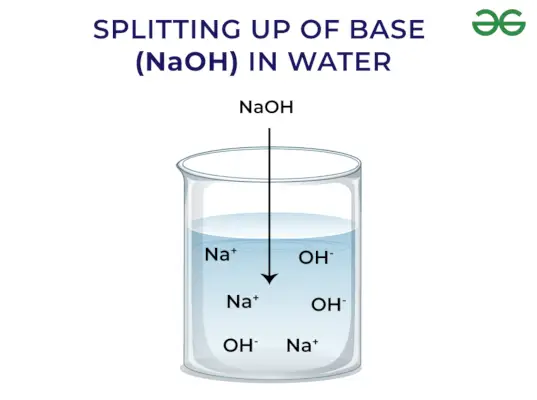
Podľa Arrheniusovho konceptu sú zásady zlúčeniny, ktoré pri rozpustení vo vode uvoľňujú hydroxidové ióny a zvyšujú koncentráciu hydroxylových iónov vo vodnom roztoku. Napríklad, keď sa KOH rozpustí vo vode, poskytne OH–iónu a tým zvýšiť koncentráciu OH–vo vode.
Bronsted Base
Bronsted Concept of Base je pokročilá verzia Arrheniusovho konceptu, ktorý uvádza, že zásady sú zlúčeniny, ktoré prijímajú H+ión alebo protón za vzniku ich konjugovanej kyseliny. Napríklad Cl–je základ, ktorý akceptuje H+za vzniku HCl ako jeho konjugovanej kyseliny.
Typy základov
Zásady možno klasifikovať na základe kyslosti, koncentrácie a ionizačnej schopnosti. Klasifikácia je uvedená nižšie
Typy zásad na základe kyslosti
Kyslosť zásady označuje počet zameniteľných hydroxylových skupín prítomných v jednej molekule zásady. Na základe kyslosti sú zásady rozdelené do troch kategórií:
python triediace n-tice
- Monoacidická báza
- Diacidická báza
- Triacidická báza
Monokyslé: Monokyslé bázy sú tie, ktoré obsahujú iba jeden zameniteľný hydroxylový ión a interagujú iba s jedným vodíkovým iónom. Monokyselinové zásady zahŕňajú NaOH, KOH a ďalšie.
Diacidický: Dikyselinová báza je báza s dvoma vymeniteľnými hydroxylovými iónmi, ktoré interagujú s dvoma vodíkovými iónmi. Ca(OH)2, Mg(OH)2a ďalšie dvojkyselinové zásady sú príklady.
Triacid: Triacidická báza je typ bázy, ktorá obsahuje tri vymeniteľné hydroxylové ióny a tri vodíkové ióny. Trikyselinové zásady zahŕňajú Al(OH)3, Fe(OH)3, a ďalšie.
Typy zásad na základe ich koncentrácie vo vodnom roztoku
Koncentrácia sa týka množstva zásady prítomnej vo vodnom roztoku. Na základe ich koncentrácie vo vodnom roztoku sa zásady delia do dvoch kategórií:
- Koncentrovaná báza
- Zriedená báza
Koncentrovaný základ: Koncentrované zásady sú tie, v ktorých je množstvo zásady veľké v porovnaní s rozpúšťadlom. Napríklad koncentrovaný roztok NaOH.
Zriedený základ: Tieto typy zásad majú vo svojom vodnom roztoku nižšiu koncentráciu zásady. Riedenie je proces znižovania percenta rozpustenej látky pridaním väčšieho množstva rozpúšťadla. Napríklad riediť NaOH, riediť KOH atď.
Typy báz na základe stupňa ionizácie
Stupeň ionizácie sa vzťahuje na schopnosť chemickej zlúčeniny uvoľniť svoj základný ión, keď sa rozpustí vo vode. V prípade zásady sa stupeň ionizácie vzťahuje na schopnosť zásady uvoľňovať OH–ióny, keď sú rozpustené vo vode. Na základe stupňa ionizácie sú zásady rozdelené do dvoch typov:
konvertovať reťazec na objekt json
- Silná základňa
- Slabá základňa
Silná základňa: Silné zásady sú také zásady, ktoré sa po rozpustení vo vode úplne disociujú a uvoľňujú OH- ión. Niektoré príklady silných zásad zahŕňajú NaOH, KOH atď.
Slabá základňa: Bázy, ktoré nepodliehajú úplnej disociácii a uvoľňujú iba zlomok OH- iónu, sa nazývajú slabá báza. Príklady slabých zásad zahŕňajú Al(OH)3,Cu(OH)2,atď.
Uč sa viac, Silné a slabé základy
Vlastnosti báz
Keďže vieme, že zásady sú chemické zlúčeniny, ktoré majú OH- ión, sfarbujú sa na červený lakmusový modrý atď. V tejto časti sa dozvieme o fyzikálnych a chemických vlastnostiach zásad spolu s niekoľkými krátkymi znalosťami o ich všeobecných vlastnostiach.
Všeobecné vlastnosti bázy
Všeobecné vlastnosti báz sú uvedené nižšie:
- Hydroxidový ión (OH–) sa uvoľňuje do vody zásadami. Čím silnejšia je báza, tým viac iónov sa uvoľňuje.
- Zásady reagujú s kyselinou za vzniku soli Kyseliny reagujú so zásadami. Táto reakcia zásady s kyselinou sa nazýva neutralizačná reakcia.
- Základy sa sfarbujú z červeného lakmusu do modra.
- Štruktúra proteínu môže byť zmenená zásadami. Bázy majú túto kvalitu, vďaka čomu sa cítia hladko. Mydlo je základ, ktorý sa neuveriteľne šmýka na pokožke, keď je vlhký. Kvôli svojej schopnosti modifikovať štruktúru proteínov sú niektoré silné bázy mimoriadne nebezpečné.
Fyzikálne vlastnosti báz
Základ má horkú chuť: Základy sú horkej chuti. Pre jeho horkosť máme len málo zásadotvorných potravín. Existuje len niekoľko zásaditých potravinárskych materiálov. Zásady je potrebné ochutnávať opatrnejšie v porovnaní s kyselinami.
Základy sú na dotyk klzké: Pri dotyku Bázy sú šmykľavé. Napríklad mydlo.
Bázy uvoľňujú OH – Ión: Keď sa zásady rozpustia vo vode, uvoľňujú hydroxylový ión (OH–). V závislosti od schopnosti uvoľňovať hydroxylové ióny sú klasifikované ako silné a slabé.
Bázy neutralizujú kyseliny: Keď Zásady reagujú s kyselinami, navzájom sa neutralizujú a vytvárajú soľ a vodu. Táto reakcia sa nazýva Neutralizačná reakcia . Povedzme, že máme kyselinu HY a zásadu „XOH“, potom vytvorená soľ bude „XY“. Rovnica pre túto reakciu môže byť uvedená ako HY + XOH → HOH + XY.
Základ denaturačného proteínu: Denaturácia proteínu znamená zničenie stability a štruktúry proteínu. To spôsobuje, že používanie zásady je pre človeka škodlivé, pretože ľudská pokožka a vlasy sú zložené z bielkovín a keď sa použijú silné alkálie, ako je hydroxid sodný alebo draselný, nazývaný aj lúh, majú škodlivý vplyv na ľudskú pokožku.
Základy menia červený lakmus na modrý: Keď sa báza dostane do kontaktu s červeným lakmusom, zmení sa na modrý. Treba si však uvedomiť, že pri pokuse o reakciu suchej bázy s červeným lakmusovým papierikom takúto zmenu nepozorujeme. Test lakmusovým papierikom je jednou z najstarších metód testovania základne. Existujú však aj iné indikátory, ako je fenolftaleín
Základňa vedie elektrinu: Keď sú bázy vo forme roztoku, majú mobilné OH-ióny, a preto môžu viesť elektrinu.
Chemické vlastnosti zásad
- Reakcia bázy s kovmi: Keď zásada (báza) reaguje s kovom, vzniká soľ a plynný vodík.
Alkálie + kov → soľ + vodík
Príklady:
- Keď hydroxid sodný interaguje s kovovým hliníkom, vzniká hlinitan sodný a plynný vodík.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Keď hydroxid sodný interaguje s kovovým zinkom, vytvára plynný vodík a zinok sodný.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reakcia nekovových oxidov s bázou: Soľ a voda vznikajú pri reakcii nekovových oxidov so zásadou.
Nekovový oxid + Báza → Soľ + Voda
Keď hydroxid vápenatý reaguje zásada s oxidom uhličitým, potom vzniká uhličitan vápenatý a voda.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reakcia alkálií/zásad s amónnymi soľami: Amoniak vzniká, keď alkálie reagujú s amónnymi soľami.
Alkálie + amónna soľ → soľ + voda + amoniak
Keď hydroxid vápenatý reaguje s chloridom amónnym, vzniká chlorid vápenatý voda a amoniak.
Ca(OH) 2 + NH 4 Cl -> CaCl 2 + H 2 O + NH 3
mb vs gb
Príklady báz
Základy sú všeobecne oxidy kovov, hydroxidy kovov, hydrogenuhličitany kovov, uhličitany kovov atď. Pozrime sa na niektoré príklady zásad s ich aplikáciou v tabuľkovej forme:
| Základy tlačidlo v strede css | Aplikácie |
|---|---|
| Hydroxid draselný KOH | Používa sa v alkalických batériách |
| Hydroxid sodný NaOH | Používa sa pri výrobe mydla a pracích prostriedkov |
| Hydroxid horečnatý Mg(OH) 2 | Používa sa ako antacidá |
| Hydrogenuhličitan sodný NaHCO 3 | Používa sa ako sóda bikarbóna |
| Uhličitan sodný Už 2 CO 3 | Používa sa ako sóda na pranie |
| Amoniak NH 3 | Používa sa pri výrobe čistiacich a farmaceutických produktov prevod na reťazec |
| Hydroxid vápenatý Ca(OH) 2 | Používa sa na bielenie |
Použitie báz
Existujú rôzne prípady použitia základne, niektoré z nich sú:
- Hydroxid sodný sa používa pri výrobe mydla a papiera. Hydroxid sodný (NaOH) sa tiež používa pri výrobe umelého hodvábu.
- Bieliaci prášok je vyrobený z Ca(OH)2, bežne známy ako hasené vápno alebo hydroxid vápenatý.
- Hydroxid vápenatý sa používa na vytváranie suchých zmesí na maľovanie a zdobenie.
- Hydroxid horečnatý, ľudovo známy ako magnéziové mlieko, je laxatívum, ktoré sa vo veľkej miere používa. Používa sa tiež ako antacidum, pretože znižuje nadmernú kyslosť v ľudskom žalúdku.
- V laboratóriách je hydroxid amónny kritickým činidlom.
- Hasené vápno sa môže použiť na neutralizáciu nadmernej kyslosti v pôde.
Čítaj viac
- Kyselina, zásada a soľ
- Sila kyseliny
- Ionizácia kyseliny a zásady
Často kladené otázky o zásadách v chémii
1. Čo sú základy?
- Základné zlúčeniny majú horkú príchuť.
- Textúra väčšiny báz je mydlová.
- Pri testovaní na lakmusovom papieri vo väčšine prípadov premení červený lakmusový papierik na modrý lakmusový papierik.
- V roztoku základné zlúčeniny tiež vedú elektrický prúd.
- Keď sa základné zlúčeniny rozpustia vo vode, uvoľnia sa OH- ióny.
2. Aké sú funkcie báz?
V domácnostiach používame bázy ako čistiace prostriedky a antacidá. Mydlá, lúh (ktorý sa používa v čistiacich prostriedkoch na pečenie), magnéziové mlieko a tumy sú príkladmi populárnych domácich základov. Každý z nich má pH vyššie ako sedem, dokáže spotrebovať voľný vodík a neutralizovať kyseliny.
3. Aký je najdôležitejší rozdiel medzi kyselinou a zásadou?
Kyseliny a zásady sú dva typy korozívnych chemikálií. Kyslé materiály majú hodnotu pH medzi 0 a 7, zatiaľ čo zásady majú hodnotu pH medzi 7 a 14. Kyseliny sú iónové chemikálie, ktoré sa rozkladajú vo vode a vytvárajú vodíkový ión (H+), zatiaľ čo zásada disociuje za vzniku OH- iónu.
4. Aké sú fyzikálne vlastnosti báz?
- Majú horkú chuť.
- Ich vodné roztoky majú mydlovú kvalitu.
- Menia farbu lakmusového papierika z červenej na modrú.
- Ich vodné roztoky sú elektricky vodivé.
- S uvoľňovaním plynného vodíka reagujú zásady s kovmi za vzniku soli.
5. Čo sa stane, keď hydroxid vápenatý reaguje s chloridom amónnym?
Keď hydroxid vápenatý reaguje s chloridom amónnym, vzniká chlorid vápenatý voda a amoniak.
Ca(OH) 2 + NH 4 Cl -> CaCl 2 + H 2 O + NH 3
6. Čo sa stane, keď hydroxid sodný zreaguje s kovovým zinkom?
Keď hydroxid sodný interaguje s kovovým zinkom, vytvára plynný vodík a zinok sodný.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Čo je Lewis Base?
Lewisova báza sú zlúčeniny, ktoré darujú elektrónový pár zlúčenine s deficitom elektrónov. Príklad zahŕňa NH3.
8. Z čoho sú základne vyrobené?
Bázy vo všeobecnosti pozostávajú z OH–ión. Okrem týchto oxidov kovov sú zásadami aj uhličitany a hydrogénuhličitany.
9. Čo sú alkálie?
Zásady, ktoré sú rozpustné vo vode, sa nazývajú zásady. Príkladom je hydroxid sodný NaOH.
10. Čo sú silné a slabé základne?
Bázy, ktoré úplne disociujú za vzniku OH–ióny po rozpustení vo vode sa nazývajú silná báza. Príklady zahŕňajú NaOH. Slabé bázy sú tie, ktoré sa úplne nedisociujú, aby uvoľnili OH–ión sa nazýva slabá zásada. Príklady slabých zásad zahŕňajú hydroxid amónny.
